
邢台铝单板批发厂家一言既出驷马难追(免疫疗法治疗胆管癌)
发布时间:2023-04-30 12:04:10 人气:47 来源:铝单板厂家
原标题:胆道癌两大免疫疗法正面冲突,双免方案能否打破僵局?作者:找药宝典随着KEYNOTE-966试验的成功,胆道癌的免疫赛道上不再是度伐利尤单抗(Imfinzi)一家独大根据美国癌症研究协会(AACR)年会上分享的数据,将帕博利珠单抗(Keytruda)结合标准化疗可将以前未经治疗的晚期或转移性胆道癌患者的死亡风险降低17%,略低于度伐利尤单抗在其自己的TOPAZ-1试验中提出的20%,该试验于去年9月为阿斯利康赢得了FDA的批准。
来自3期KEYNOTE-966试验的结果同时发表在《柳叶刀》上试验研究人员在论文中表示,总体生存率的改善具有统计学意义和临床意义 现有胆道癌免疫方案仍不理想虽然这两项研究在研究设计和结果方面有所不同但从数据来看,这两种方案都远非理想方案。
帕博利珠单抗的试验规模更大,有1069名随机患者,而度伐利尤单抗试验有685名患者由于KEYNOTE-966在亚洲以外的患者比例高于TOPAZ-1,其结论可能“更能代表全球人口” 然而,这两项试验的改善远不如其他免疫治疗试验那么大。
例如KEYNOTE-024研究中,帕博利珠单抗+化疗中位OS 为 26.3个月,化疗仅为13.4个月,生存提升十分显著而胆管癌中,免疫治疗的改善则相对“乏善可陈” 在KEYNOTE-966中,帕博利珠单抗+化疗患者的。
中位OS为12.7个月,而单独化疗的患者为10.9个月。
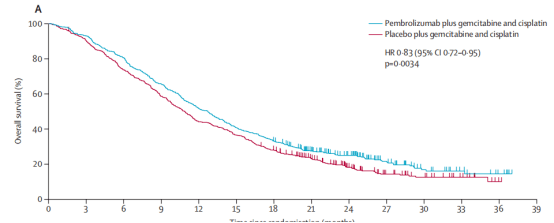
K+ GemCis的KM曲线 在TOPAZ-1中,服用Imfinzi和化疗的患者的 中位OS为12.8个月,而对照组为11.5个月。
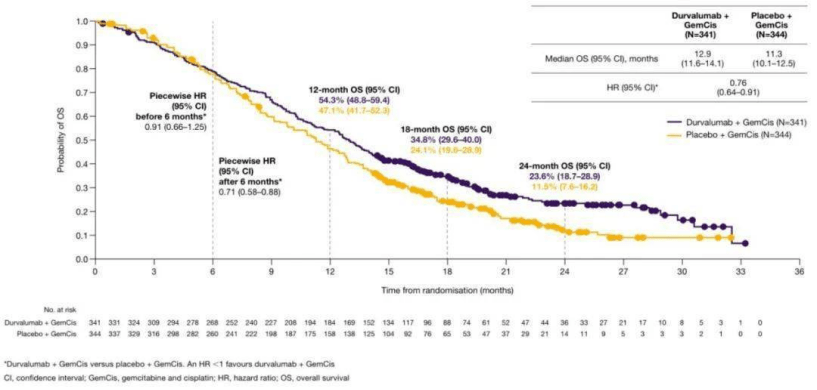
D + GemCis的KM曲线在各自的试验中,两种方案的两年生存率几乎相同,均为25%然而,与化疗相比,帕博利珠单抗方案的无进展生存期(PFS)风险降低了14%,这不符合统计学意义标准而度伐利尤单抗在TOPAZ-1中,在PFS风险上显著减少了25%。
在帕博利珠单抗试验中,两组之间的肿瘤缓解率也非常相似(ORR:29%和28%)但是帕博利珠单抗接受者在中位缓解持续时间更长为9.7个月,而对照组为6.9个月 而度伐利尤单抗的试验中肿瘤缓解则较为显著,联合组ORR为26.7%,而单独化疗组的ORR为18.7%。
研究人员在AACR上总结道,这两项试验都标志着胆道癌领域的重大进展,并共同验证了免疫检查点抑制与化疗相结合作为晚期胆道癌一线疗法的作用 还有哪些值得期待的免疫疗法?目前有多项试验将免疫检查点抑制剂(ICIs)与其他检查点抑制剂、细胞毒性化疗、靶向治疗或区域治疗相结合。
正如在非小细胞肺癌和肝细胞癌中的结果,在其他实体肿瘤中,当PD-L1药物与CTLA-4抗体联合使用时,也取得了显著的成功这些研究中有两个值得注意的是双CTLA-4和PD-1阻断剂研究在晚期胆道癌中进行 。
2期IMMUCHEC试验IMMUCHEC研究是一个多臂的一线胆道癌的小规模随机对照研究,研究的主要目的是探索PD-L1 抑制剂度伐利尤单抗(D)和CTLA-4 抑制剂tremelimumab(T)联合吉西他滨(Gem)和顺铂(Cis)的疗效。
试验包括6个组, 试验治疗方案如下: A组D 1.5g Q3W+4xT 75mg Q3W+gem 1000 mg/m2(D+4T+G); B组D 1.5g Q3W+4xT 75mg Q3W+Gem 1000 mg/m2+Cis 25mg/m2(D+4T+GC); C组(对照组)Gem+Cis(GC); D组 D 1.5g Q3W + 1xT 300mg+Gem+Cis(D+1T+GC); E组 D 1.5g Q3W + Gem + Cis(D+GC)。
根据ESMO2022上公布的研究结果如下:
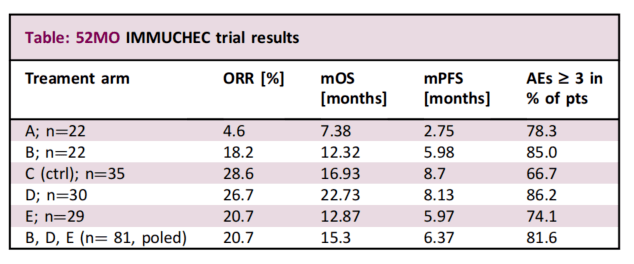
A组:OS为7.38个月,PFS为2.75个月;B组:OS为12.32个月,PFS为5.98个月; C组(对照):OS为16.93个月,PFS为8.7个月;D组:OS为22.73个月,PFS为8.13个月;E组
OS为12.87个月,PFS为5.97个月 虽然本次研究未能显著改善ORR,但 D组高达22个月的长期生存让人印象深刻不良反应方面未出现新的安全性信号 2期IMMUNOBIL PRODIGE 57试验MMUNOBIL PRODIGE-57 研究旨在评估“D+T”方案在铂类化疗失败后的晚期胆道癌患者中的安全性和有效性。
该研究是一项双臂、随机非对照、开放标签、II期临床研究,入组患者为经病理确诊的复发或晚期胆道癌(BTC),在接受含铂化疗后进展(至多1线治疗)研究分为两个队列: 队列A:D1500mg Q4W + T 75mg Q4W(D+T75),后进一步修改方案为D 1500mg Q4W+单次T 300mg(D+T300)。
队列B:D1500mg Q4W +T 75mg Q4W同时联合紫杉醇 QW(D+T75+紫杉醇),但该队列入组10例患者后因毒性问题已关闭 根据ASCO 2022上的中期研究结果显示,103例ITT人群中,2例完全缓解(CR),8例部分缓解(PR),ORR为9.7%;32例疾病稳定(SD),DCR为40.8%。
中位DoR为7.6个月(95%CI 1.8-12.9)
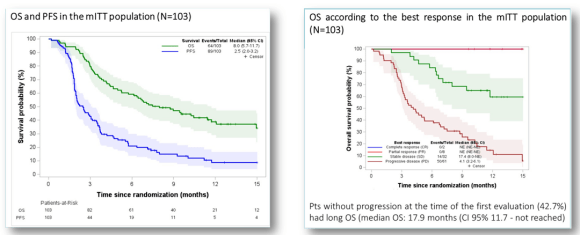
中位随访12个月,6个月OS率为59.2%mOS为8.0个月(95%CI 5.7-11.7);PFS为2.5个月(95%CI 2.0-3.2);在首次评估时,没有出现疾病进展的患者具有更长的OS(6个月OS率:84% vs 41%,。
中位OS: 17.9个月vs 4.4个月)在安全性方面,这一治疗方案是可耐受的,没有发现非预期的治疗相关的3-4级不良事件更换治疗方案的队列 A(D+T300)以及相关的辅助研究正在开展中,期待后续结果的公布。
向上滑动阅览参考文献1.Robin Kate Kelley; Makoto Ueno; Changhoon Yoo; Richard S Finn; Junji Furuse; et al. Pembrolizumab in combination with gemcitabine and cisplatin compared with gemcitabine and cisplatin alone for patients with advanced biliary tract cancer (KEYNOTE-966): a randomised, double-blind, placebo-controlled, phase 3 trial. Published:April 16, 2023DOI:https://doi.org/10.1016/S0140-6736(23)00727-4
2. FDA approves durvalumab for locally advanced or metastatic biliary tract cancer. News release. FDA. September 2, 2022. Accessed April 16, 2023. https://www.fda.gov/drugs/resources-information-approved-drugs/
3.Durvalumab (D) plus tremelimumab (T) immunotherapy in patients (Pts) with advanced biliary tract carcinoma (BTC) after failure of platinum-based chemotherapy (CTx): Interim results of the IMMUNOBIL GERCOR D18-1 PRODIGE-57 study. Journal of Clinical Oncology 2022 40:16_suppl, 4108-4108
4.52MO - A randomized phase II trial of durvalumab and tremelIMUmab with gemcitabine or gemcitabine and cisplatin compared to gemcitabine and cisplatin in treatment-naïve patients with CHolangio- and gallbladdEr Carcinoma (IMMUCHEC)
声明:本资料中涉及的信息仅供参考,请遵从医生或其他医疗卫生专业人士的意见或指导本文转载自其他网站,不代表健康界观点和立场如有内容和图片的著作权异议,请及时联系我们(邮箱:guikequan@hmkx.cn)。
返回搜狐,查看更多责任编辑:
相关新闻
- 铝单板厂家联系电话号码高效便捷种类齐全(红米多少个系列) 2023-05-03
- 南昌铝单板厂家电话按照客户要求定制(realme 真我gt neo 5g怎么样) 2023-05-03
- 木纹铝单板厂家直销专业售后品质保证(红米快充多少钱一个) 2023-05-03
- 铝单板厂家排名及价格全国发货及时供应(redmi k60pro) 2023-05-03
- 铝单板厂家哪家好全国发货及时供应(红米note128g多少钱) 2023-05-03
- 铝单板厂家联系电话号码高效便捷种类齐全(红米多少个系列) 2023-05-03
- 承德铝单板厂家佛是金装人是衣装(波兰吞并切欣) 2023-05-02
- 张家口铝单板厂家哪家好塞翁失马焉知非福(英国老师几点上班) 2023-05-02
- 保定铝单板批发厂家养兵千日用兵一时(西安有几家世界500强企业) 2023-05-02
- 石家庄铝单板批发厂家一言既出驷马难追(中国在2030年的五大超级都市圈) 2023-05-02











 客服
客服